这4项标准内容对企业实施UDI有重要的指导意义
2021年5月国家药监局发布了最新的医疗器械标准目录汇编。包含现行:
国家标准 227 项(强制性标准 93 项,推荐性标准 134 项)。
行业标准 1564 项(强制性标准 303 项,推荐性标准 1261 项)。
其中,关于医疗器械唯一标识的标准共有4项。
2项UDI基础通用和2项UDI信息化,分别是:
《YY/T1630-2018 医疗器械唯一标识基本要求》
《YY/T1681-2019医疗器械唯一标识系统基础术语》
《YY/T1752-2020医疗器械唯一标识数据库基本数据集》
《YY/T1753-2020医疗器械唯一标识数据库填报指南》
这4项标准内容全部围绕医疗器械唯一标识(UDI)展开,对企业实施UDI有重要的指导意义。

《YY/T1630-2018 医疗器械唯一标识基本要求》
该标准规定了医疗器械唯一标识的相关术语和定义、基本原则、产品标识的要求和生产标识的要求,适用于医疗器械唯一标识的管理。
包含4大常用术语和2项标识要求以及医疗器械唯一标识结构示意图和产品标识与医疗器械的包装示意图。
《YY/T1681-2019医疗器械唯一标识系统基础术语》
该标准界定了医疗器械唯一标识系统的基础术语和定义。包括6项通用术语定义、5项医疗器械唯一标识术语定义、5项医疗器械唯一标识数据载体术语定义和2项医疗器械唯一标识数据库术语定义。
《YY/T1752-2020医疗器械唯一标识数据库基本数据集》
该标准规定了医疗器械唯一标识数据库所涉及的基本数据集的类别、数据子集等相关内容,适用于医疗器械唯一标识数据库的建设。
医疗器械唯一标识数据库基本数据集主要包括医疗器械唯一标识数据库基本信息、医疗器械注册备案人/联系信息、医疗器械唯一标识发码机构信息数据子集。
规定了数据项处理原则、数据类型、标识格式、允许值、约束等要求。
《YY/T1753-2020医疗器械唯一标识数据库填报指南》
该标准规定了医疗器械唯一标识数据库填报产品标识及其相关信息的基本要求,适用于医疗器械唯一标识数据库的填报。主要包括数据接口交换不同格式要求详解示例和数据填报内容的要求。
除上述4项标准内容外,对于将要实施UDI的企业来说,还有一份文件也是必看的,即《医疗器械唯一标识系统规则》。
此《规则》根据《医疗器械监督管理条例》制定,共计十八条。包含了医疗器械唯一标识系统的组成与定义、医疗器械唯一标识实施原则与意义、医疗器械唯一标识实施对象与要求、医疗器械唯一标识实施载体要求和医疗器械唯一标识数据库要求等内容。
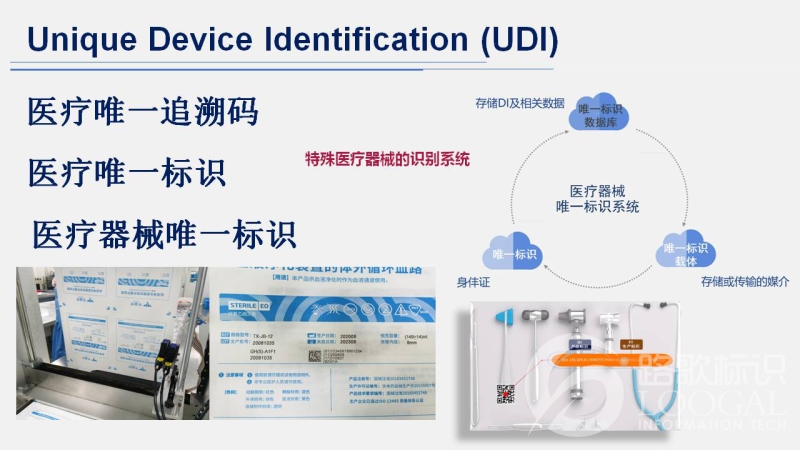
上海路歌信息技术有限公司作为GS1官方指定第三方方案提供商,是专业的提供UDI流程落地实施方案企业。上海路歌可为企业提供正确编码指导服务、合规申报引导服务、合理赋码方案规划,协助医疗企业更便捷有序的实施UDI医疗器械唯一标识赋码项目。






